Importancia de los canales de K+ en la relajación del músculo liso traqueal inducida por el salbutamol
DOI:
https://doi.org/10.58713/rf.v2i2.1Palabras clave:
Salbutamol, Músculo liso, Canales de K+Resumen
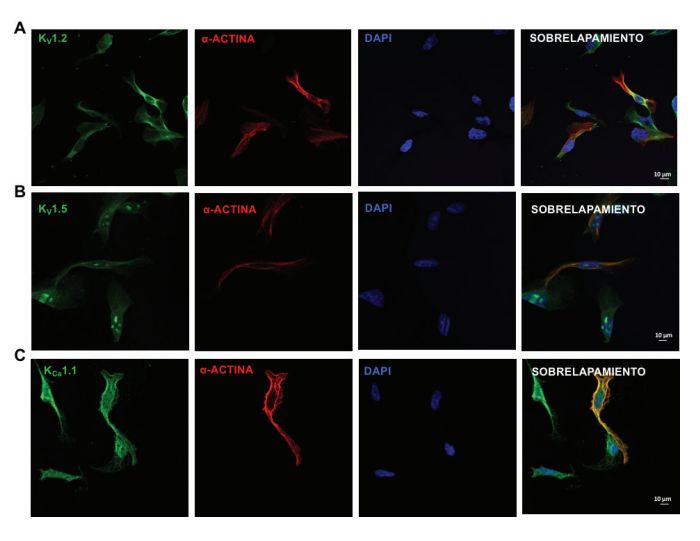
El salbutamol es un agonista del receptor adrenérgico β2 (RAβ2) utilizado como medicamento de primera línea para revertir el broncoespasmo en pacientes asmáticos o con enfermedad pulmonar obstructiva crónica (EPOC). La vía de señalización del RAβ2 ha sido bien estudiada en los distintos tipos de músculo liso, incluyendo el traqueal (MLT). La activación de la proteína cinasa A (PKA) vía el RAβ2 fosforila diversas proteínas blanco implicadas en la relajación del músculo liso tales como la fosfolipasa Cβ, los receptores de inositol trifosfato y el fosfolamban. Además, está reportado que los canales de K+ localizados en la membrana plasmática de los diferentes músculos lisos son blanco de la PKA, y su apertura conduce a la hiperpolarización, lo que contribuye a la relajación. Por lo tanto, el objetivo de este trabajo fue explorar el mecanismo principal inducido por el salbutamol para relajar el MLT. En miocitos traqueales de cobayo, utilizando inmunofluorescencia, se detectó la presencia de tres isoformas de los canales de K+: el KV1.2, el KV1.5 y el KCa1.1. El salbutamol produjo la relajación del MLT de cobayo y el tetraetilamonio (TEA, bloqueador inespecífico de los canales de K+) disminuyó significativamente este efecto. En los miocitos traqueales, el salbutamol aumentó las corrientes de K+ y fueron bloqueadas por TEA. Por lo tanto, podemos concluir que el mecanismo más importante por el que el salbutamol induce la relajación del músculo liso traqueal es a través de los canales KV1.2, KV1.5 y KCa1.1.Citas
Sears MR, Lotvall J. Past, present and future-β2-adrenoceptor agonists in asthma management. Respir Med. 2005;99(2):152-70.
O’Donnell DE, Forkert L, Webb KA. Evaluation of bronchodilator responses in patients with “irreversible” emphysema. Eur Respir J. 2001;18(6):914-20.
Sitkauskiene B, Sakalauskas R, Malakauskas K, Lotvall J. Reversibility to a β2-agonist in COPD: relationship to atopy and neutrophil activation. Respir Med. 2003;97(6):591-8.
Carbajal-García A, Reyes-García J, Casas-Hernández MF, Flores-Soto E, Díaz-Hernández V, Solis-Chagoyán H, et al. Testosterone augments β2 adrenergic receptor genomic transcription increasing salbutamol relaxation in airway smooth muscle. Mol Cell Endocrinol. 2020;510:110801.
Birrell MA, Bonvini SJ, Wortley MA, Buckley J, Yew-Booth L, Maher SA, et al. The role of adenylyl cyclase isoform 6 in β-adrenoceptor signalling in murine airways. Br J Pharmacol. 2015;172(1):131-41.
Billington CK, Penn RB. Signaling and regulation of G protein-coupled receptors in airway smooth muscle. Respir Res. 2003;4(1):2.
Schramm CM, Chuang ST, Grunstein MM. cAMP generation inhibits inositol 1,4,5-trisphosphate binding in rabbit tracheal smooth muscle. Am J Physiol. 1995;269(5 Pt 1):L715-9.
Yue C, Dodge KL, Weber G, Sanborn BM. Phosphorylation of serine 1105 by protein kinase A inhibits phospholipase Cβ3 stimulation by Gαq. J Biol Chem. 1998;273(29):18023-7.
Wellman GC, Santana LF, Bonev AD, Nelson MT. Role of phospholamban in the modulation of arterial Ca2+ sparks and Ca2+-activated K+ channels by cAMP. Am J Physiol Cell Physiol. 2001;281(3):C1029-37.
Montaño LM, Cruz-Valderrama JE, Figueroa A, Flores-Soto E, García-Hernández LM, Carbajal V, et al. Characterization of P2Y receptors mediating ATP induced relaxation in guinea pig airway smooth muscle: involvement of prostaglandins and K+ channels. Pflugers Arch. 2011;462(4):573-85.
Campos-Bedolla P, Vargas MH, Segura P, Carbajal V, Calixto E, Figueroa A, et al. Airway smooth muscle relaxation induced by 5-HT2A receptors: role of Na+/K+-ATPase pump and Ca2+-activated K+ channels. Life Sci. 2008;83(11-12):438-46.
Kume H, Hall IP, Washabau RJ, Takagi K, Kotlikoff MI. β-adrenergic agonists regulate KCa channels in airway smooth muscle by cAMP-dependent and -independent mechanisms. J Clin Invest. 1994;93(1):371-9.
Mason HS, Latten MJ, Godoy LD, Horowitz B, Kenyon JL. Modulation of KV1.5 currents by protein kinase A, tyrosine kinase, and protein tyrosine phosphatase requires an intact cytoskeleton. Mol Pharmacol. 2002;61(2):285-93.
Kotlikoff MI. Potassium channels in airway smooth muscle: a tale of two channels. Pharmacol Ther. 1993;58(1):1-12.
Imaizumi Y, Watanabe M. The effect of tetraethylammonium chloride on potassium permeability in the smooth muscle cell membrane of canine trachea. J Physiol. 1981;316:33-46.
Taylor CW. Regulation of IP3 receptors by cyclic AMP. Cell Calcium. 2017;63:48-52.
Bai Y, Sanderson MJ. Airway smooth muscle relaxation results from a reduction in the frequency of Ca2+ oscillations induced by a cAMP-mediated inhibition of the IP3 receptor. Respir Res. 2006;7:34.
Yang CM, Hsu MC, Tsao HL, Chiu CT, Ong R, Hsieh JT, et al. Effect of cAMP elevating agents on carbachol-induced phosphoinositide hydrolysis and calcium mobilization in cultured canine tracheal smooth muscle cells. Cell Calcium. 1996;19(3):243-54.
Hirshman CA, Zhu D, Panettieri RA, Emala CW. Actin depolymerization via the β-adrenoceptor in airway smooth muscle cells: a novel PKA-independent pathway. Am J Physiol Cell Physiol. 2001;281(5):C1468-76.
Horman S, Morel N, Vertommen D, Hussain N, Neumann D, Beauloye C, et al. AMP-activated protein kinase phosphorylates and desensitizes smooth muscle myosin light chain kinase. J Biol Chem. 2008;283(27):18505-12.
Sathish V, Thompson MA, Bailey JP, Pabelick CM, Prakash YS, Sieck GC. Effect of proinflammatory cytokines on regulation of sarcoplasmic reticulum Ca2+ reuptake in human airway smooth muscle. Am J Physiol Lung Cell Mol Physiol. 2009;297(1):L26-34.
Xiong DJP, Martin JG, Lauzon AM. Airway smooth muscle function in asthma. Front Physiol. 2022;13:993406.
Wang ZW, Kotlikoff MI. Activation of KCa channels in airway smooth muscle cells by endogenous protein kinase A. Am J Physiol. 1996;271(1 Pt 1):L100-5.
Boyle JP, Tomasic M, Kotlikoff MI. Delayed rectifier potassium channels in canine and porcine airway smooth muscle cells. J Physiol. 1992;447:329-50.
Brueggemann LI, Cribbs LL, Schwartz J, Wang M, Kouta A, Byron KL. Mechanisms of PKA-Dependent Potentiation of KV7.5 Channel Activity in Human Airway Smooth Muscle Cells. Int J Mol Sci. 2018;19(8).
Miura M, Belvisi MG, Stretton CD, Yacoub MH, Barnes PJ. Role of potassium channels in bronchodilator responses in human airways. Am Rev Respir Dis. 1992;146(1):132-6.
Reyes-García J, Díaz-Hernández V, Carbajal-García A, Casas-Hernández MF, Sommer B, Montaño LM. Theophylline-Induced Relaxation Is Enhanced after Testosterone Treatment via Increased KV1.2 and KV1.5 Protein Expression in Guinea Pig Tracheal Smooth Muscle. Int J Mol Sci. 2023;24(6):21.
Adda S, Fleischmann BK, Freedman BD, Yu M, Hay DW, Kotlikoff MI. Expression and function of voltage-dependent potassium channel genes in human airway smooth muscle. J Biol Chem. 1996;271(22):13239-43.
Allen SL, Boyle JP, Cortijo J, Foster RW, Morgan GP, Small RC. Electrical and mechanical effects of BRL34915 in guinea-pig isolated trachealis. Br J Pharmacol. 1986;89(2):395-405.
Black JL, Armour CL, Johnson PR, Alouan LA, Barnes PJ. The action of a potassium channel activator, BRL 38227 (lemakalim), on human airway smooth muscle. Am Rev Respir Dis. 1990;142(6 Pt 1):1384-9.
Williams AJ, Lee TH, Cochrane GM, Hopkirk A, Vyse T, Chiew F, et al. Attenuation of nocturnal asthma by cromakalim. Lancet. 1990;336(8711):334-6.
Kidney JC, Fuller RW, Worsdell YM, Lavender EA, Chung KF, Barnes PJ. Effect of an oral potassium channel activator, BRL 38227, on airway function and responsiveness in asthmatic patients: comparison with oral salbutamol. Thorax. 1993;48(2):130-3.
Pelaia G, Gallelli L, Vatrella A, Grembiale RD, Maselli R, De Sarro GB, et al. Potential role of potassium channel openers in the treatment of asthma and chronic obstructive pulmonary disease. Life Sci. 2002;70(9):977-90.