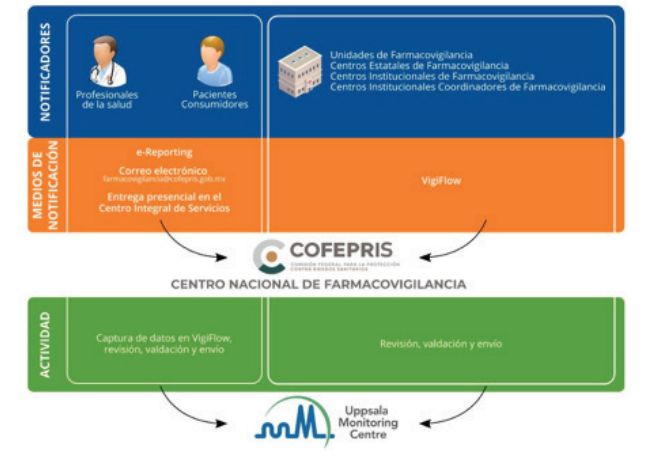
Farmacovigilancia a través del Programa Epidemiológico de Vigilancia de Insumos para la Salud UNAM
DOI:
https://doi.org/10.58713/rf.v2i1.2Keywords:
Farmacovigilancia, Farmacoepidemiología, Salud públicaAbstract
Objetivo: Describir y analizar los datos generados por el Programa Epidemiológico de Vigilancia de Insumos para la Salud (PREVIS).
Material y métodos: La recolección de los datos relacionados a las reacciones adversas se realizó mediante el análisis de la plataforma electrónica de PREVIS.
Resultados: Se analizaron un total de 554 notificaciones; 60% correspondió al género femenino, 31% al masculino y en 9% de las notificaciones no se especificó el género. Se describieron 1519 reacciones adversas, relacionadas a 686 medicamentos sospechosos. 17% de las reacciones fueron clasificadas como
leves, 75% como moderadas y el 3% de las reacciones fueron clasificadas como severas. Los agentes antineoplásicos fue el grupo farmacológico involucrado con mayor frecuencia.
Conclusiones: Las reacciones adversas observadas en su mayoría fueron de naturaleza leve y moderada. El análisis de su naturaleza ha identificado oportunidades para reducir su impacto en la salud y reducir sus costos asociados.
References
H. Congreso de la Unión. Ley General de Salud. Secretaría de Salud; 1984.
Secretaría de Salud. Norma Oficial Mexicana NOM-220-SSA1-2016, Instalación y operación de la farmacovigilancia. Diario Oficial de la Federación; 2017.
World Health Organization. Body mass index - BMI. World Health Organization; 2019.
Medical Dictionary for Regulatory Activities. MedDRA Hierarchy | MedDRA.
Langerová P, Vrtal J, Urbánek K. Adverse Drug Reactions Causing Hospital Admissions in Childhood: A Prospective, Observational, Single-Centre Study. Basic Clin Pharmacol Toxicol. 2014 Dec;115(6):560–4. https://doi. org/10.1111/bcpt.12264
Suh D-C, Woodall BS, Shin S-K, Santis ERH-D. Clinical and Economic Impact of Adverse Drug Reactions in Hospitalized Patients. Ann Pharmacother. 2000 Dec;34(12):1373–9. https://doi.org/10.1345/aph.10094
Iasella CJ, Johnson HJ, Dunn MA. Adverse Drug Reactions: Type A (Intrinsic) or Type B (Idiosyncratic). Clin Liver Dis. 2017 Feb;21(1):73–87. https://doi.org/10.1016/J. CLD.2016.08.005
Tanoshima R, Khan A, Biala AK, Trueman JN, Drögemöller BI, Wright GEB, et al. Analyses of Adverse Drug Reactions-Nationwide Active Surveillance Network: Canadian Pharmacogenomics Network for Drug Safety Database. J Clin Pharmacol. 2019 Mar;59(3):356–63. https://doi.org/10.1002/ jcph.1336
Italiano D, Perucca E. Clinical Pharmacokinetics of New-Generation Antiepileptic Drugs at the Extremes of Age: An Update. Clin Pharmacokinet. 2013 Aug 3;52(8):627–45. https://doi.org/10.1007/ s40262-013-0067-4
Black CD, Thavorn K, Coyle D, Bjerre LM. The Health System Costs of Potentially Inappropriate Prescribing: A PopulationBased, Retrospective Cohort Study Using Linked Health Administrative Databases in Ontario, Canada. PharmacoEconomics - Open. 2019 Jun;1–10. https://doi.org/10.1007/ s41669-019-0143-2
Crona DJ, Faso A, Nishijima TF, McGraw KA, Galsky MD, Milowsky MI. A Systematic Review of Strategies to Prevent Cisplatin-Induced Nephrotoxicity. Oncologist. 2017 May;22(5):609–19. https://doi.org/10.1634/ theoncologist.2016-0319
Lim K, Kim J, Kang M, Park H, Kang H. Two cases of cytarabine syndrome successfully resolved by desensitization. J Investig Allergol Clin Immunol. 2015;25(1):80–2.